|
【摘要】 目的 探讨大鼠局灶性脑梗死后皮层血流量和c—
表达的变化。方法光化学法诱导大鼠局灶性脑梗死模型,应用激光多普勒微循环测量仪检测(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)局灶性脑梗死后各时间点坏死区和半暗带皮层血流量,采用SABC免疫组化法检测局灶性脑梗死后各时间点c—
阳性反应的表达情况。结果脑梗死后坏死区皮层血流量呈波浪样改变,3 h降至最低,为正常血流量的(9.36±1.72 ,6 h后回升
,12 h达高峰,为正常的(31.18±1. %,24—48 h血流量再度下降,与3 h相比无显著性差异(P>0.05)
。半暗带皮层血流量6h降至最低,为正常皮层血流量的(30.88±7.11 ,9~48 h呈上升趋势,至48 h血流
恢复至正常的(91.90±4.56)%,较其它组有显著性差异(P<0.05)。c— 在脑梗死(脑微循环(动物),旁流暗视野,侧流暗视野)发生30
rain时半暗带区即有大量蛋白表达,并随时问的延长表达量相应增加,直至6 h达表达高峰;在梗死后3
h整个同侧皮层出现的弥漫性表达,6 h发现梗死对侧大脑皮层亦有表达。观察9
h后各个时间点的表达量逐渐减少,且只限于梗死的半暗带区。在坏死区均未见c—f0s表达。结论局灶性脑梗死(脑微循环(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)后皮层血流量和c—
的表达具有明显的时间和空间的变化规律。
【关键词】皮层血流量;c—fos;局灶性;脑梗死(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)
中图分类号:R743.33 文献标识码:B
光化学诱导大鼠局灶性脑梗死(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)模型,已被从病理、生理等方面证明与人类脑血栓形成的发病过程相似⋯。c—f0s属于立早反应基因(immediate
ea卜lygenes,IEGs)有报道c—f0s基因的表达与缺血神经元损害明显相关【2.31,而且,c—f0s的表达规律尚有争
议,深入研究大脑皮层血流量与c—fos表达的文献尚未见报道。本研究旨在探讨光化学法诱导的大鼠局灶性脑梗死(脑微循环(动物),旁流暗视野,侧流暗视野)后大脑皮层血流量、c—fos表达的规律,为进一步研究局灶性脑梗死的发病过程及防治提供实验依据。
材料与方法
1 实验动物与分组:健康雄性Wistar大鼠48只,6—8周龄,体重(260±10)g,由山东大学实验动物中心提供。按光照结束后的时间分为30
min,3、6、9、12、24、36、48 h共8组,每组6只大鼠。
2 实验设备及试剂:(1)冷光源 金属卤化灯(150 w,24
V)为发光光源,滤去全部紫外线与红外线,投射出单一绿色光束,波长(560±30)llm,光导纤维输出口至照射区距离为1.5
mm,光束投射中心直径为3 mm,光照强度为5.6×10Scd/m:,照射中心最高温度为27 cI=。(2)微循环激光多普勒测量
仪*(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术):瑞典产PeriFlux
System,型号为PF5001。(3)生理十六导仪。(4)玫瑰红(Rose Bengal,RB)和伊文思兰(Eve.s
Blue,EB)由美国Sigma公司提供。(5)c—f0s单克隆抗体、SABC及DAB试剂盒由美国Santa Cruz公司提
供。
3 局灶性脑梗死(脑微循环(动物),旁流暗视野,侧流暗视野)模型的制备:根据Waston等的方法进行改进,室温25cI=条件下,水合氯醛(0.35~kg体质量)腹腔麻醉,立体定位仪固定大鼠头部,常规消毒后,沿头正中切口分离至暴露完整的颅骨。以矢状缝右侧3
nMIl、冠状缝后3 innl为中心用牙科平钻开直径约6 nMIl的骨窗,去除颅骨表层骨板,保留下层骨板及硬脑膜。经股静脉缓慢注入5%玫瑰红(5O
mg/kg),5 min后用冷光源照射骨窗1O
min。分时间点断头取脑,处死前1 h时注射1%伊文思兰1 ml。光照后30 min的时间组因为无法注射EB而没有计算蓝染区。
4
观测指标及方法:(1)模型制作过程中和麻醉清醒后进行一般情况的观察。(2)记录各时间点的坏死区、半暗带大脑皮层(脑微循环(动物),旁流暗视野,侧流暗视野)血流量。(3)按要求时间处死时间麻醉大鼠,经心脏行主动脉插管,先用4~C生理盐水200
ml灌注至右心耳流出清澈液,再用4%多聚甲醛200 ml内固定20 min后取脑,用im—age—proplus软件系统[
]计算大脑皮层红染区(坏死区)、蓝染区(半暗带)的皮层表面积【 。(4)经6 h
4%多聚甲醛后固定,10%、20%、30%蔗糖梯度脱水,制作8/xm的冰冻切片,进行HE染色及c—f0s的SABC免疫组化。c—f0s阳性反应的细胞定量采用显微计数法(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术),每个时间点选取2张切片,随机选取5个40倍视野计数。
5
资料统计:实验结果采用单因素方差分析,数据用均数±标准差表示,P<0.05为有显著性差异。数据均应用SPSS10.0软件进行统计学处理。
结 果
1 一般情况的观察
模型制作过程中大鼠生命体征稳定:平均心率f261±42)次/min,平均呼吸(68±24)次/rain,无缺氧征象,肛温36.8~C~37.2~C,照射局部颅骨表面温度38.O
~38.8℃ 。麻醉清醒后,精神萎糜,活动及摄食减少,但均无明显肢体瘫痪。
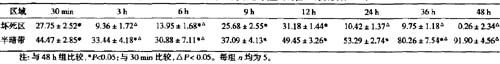
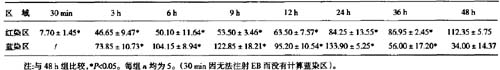
2 坏死区、半暗带区的皮层血流量坏死区大脑皮层血流量随梗(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)死时间的延长呈明显的波浪样改变(图1A)。光照后30
min即降至正常的f27.75±2.5 2)%,3 h后降至最低,为正常的9.36%±1.72%。6 h后血流量开始回升,12
h升至最高,达正常(31.18±1.44)%,较30 min具有显著性差异fP<0.05)。24~48 h血流量再度下降,与3
h相比无显著性差异(P>0.05)。半暗带皮层血流量如表1、图lB所示,光照后30
min明显下降,为正常的(44.47±2.85)%。伴随缺血时间的延长皮层血流量继续下降,6
h后降至最低,为正常的(30.88±7.11)%,较30 min有显著性差异(P<0.05)。9~24
h皮层血流量呈现缓慢上升,24 h至正常血流量的(53.29±2.74)%。36、48 h血流量大幅度上升,48
h血流量恢复至正常的(91.90±4.56)%,较其它组均具有显著差异(P<0.05)。
3 大脑皮层红染区、蓝染区的皮层表面积大脑皮层(脑微循环(动物),旁流暗视野,侧流暗视野)光照区在光照后各时间点均可见明显的红染区。除光照后30 min组因为未注射EB而无蓝染区外,其它各组亦均可见蓝染区,提示光照后血脑屏障破坏(脑微循环(动物),旁流暗视野,侧流暗视野)。梗死灶冠状切面呈“碗形”,尖端指向侧脑室,深达皮质全层,同一时间点梗死灶大。
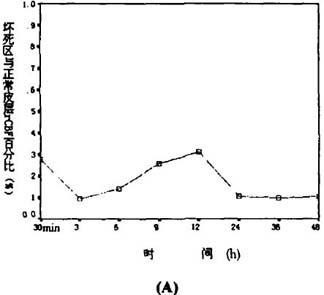 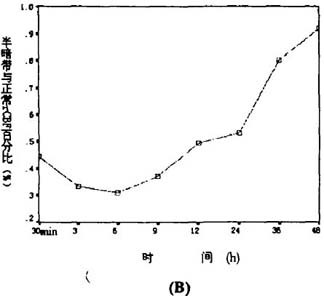
图l 坏死区和半暗带血流量的变化
表1坏死区、半暗带与正常皮层血流量的比值(%)变化表( ±s)
小一致。红染区随时间的延长逐渐增大,具有明显
的时间依赖性。而蓝染区呈明显的双峰样改变,3—
9 h呈逐渐增大的趋势,12 h后减小,24 h重新增大并升至最高点。36 h蓝染区较24 h再度减小,
48h时降至最低,见表2,图2A、B及图3,见插4。
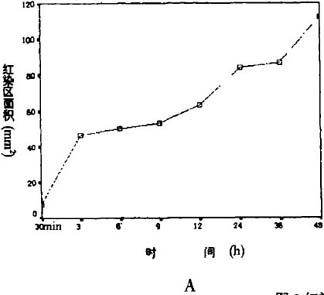 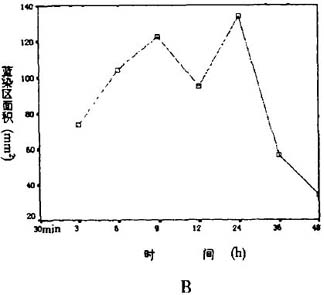
图2红染区和蓝染区的皮层表面积
表2 各时间点红染区、蓝染区的皮层表面积mm2,x 4-s)
4 HE染色的病理形态学观察
HE染色显示:坏死中心大脑皮层细胞坏死、减少,细胞核碎裂或溶解,可见微血管(脑微循环(动物),旁流暗视野,侧流暗视野)内血栓形成。随时间的延长可见坏死区不断扩大,上述表现不断加重。半暗带可见胞质浓缩脱水,细胞皱缩变小、空泡化,细胞核凝缩而无明显的溶解现象,范围呈现先增大后减小的趋势。5 c—fos免疫组织化学阳性细胞c—f0s位于胞浆内,被染成棕黄色,具有细胞形态。光照后30
min半暗带区即有c—f0s阳性细胞表达,如表3,(图5,见插4)所示,3
h后阳性细胞除在半暗带区表达继续增高外,整个同侧大脑皮层亦有表达,但密度较半暗带低。6
h后半暗带区、光照同侧大脑皮层(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)表达至高峰,但前者的表达密度比后者高,同时对侧大脑皮层(脑微循环(动物),旁流暗视野,侧流暗视野)亦有表达,但密度较光照同侧皮层稍低。9 36
h c—f0s阳性细胞呈现逐渐减少的趋势,如图4所示,且只在半暗带区分布。光照48 h后c—f0s阳性细胞降至最低,只在半暗带区呈散在性表达。坏死区于各时间点均无c—f0s阳性细胞表达。
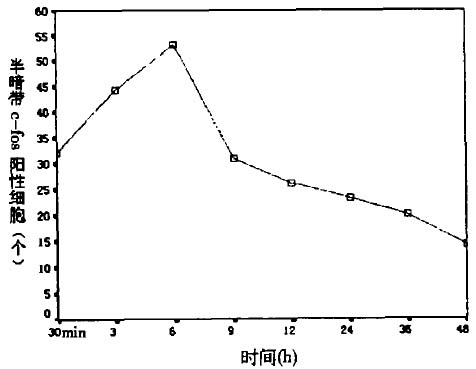
图4脑梗死(脑微循环(动物),旁流暗视野,侧流暗视野)后各时间点半暗带的c-I 阳性细胞计数
讨 论
本模型利用光化学法诱导血栓形成的原理,模拟了人类脑血栓形成的过程。通过瞬间产生大量氧自由基,造成严重的血管内皮损伤,短时间内光照区血管发生完全血栓性堵塞,形成局灶性脑梗死(脑微循环(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)。生命体征如心率、呼吸、肛温的检测及麻醉时间和照射区温度的严格控制,其主要目的是使模型的各种指标更接近临床患者的生理状态。半暗带是脑血流量介于坏死区和正常脑组织之间的一部分区域,其病理改变位于功能改变和形态损害之间,是一可以被挽救的区域。本实验研究表明,坏死中心的大脑皮层血流量降至正常灌注量的(9.36±1.72)%
一(31.18±1.44)%,坏死区周围的大脑皮层血流量降至正常灌注量的(30.88±7.1
1)%(91.90±4.56)%。半暗带(蓝染区)的重要性可从其早期的大小看出,早期是相当大的,实际上大约相当于缺血核心部位的大小,随着时间的推移,24
h轻度损伤血管迅速恢复,伴随大脑皮层(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环(脑微循环(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)监测技术)血流量的增加,半暗带的测量区域则相应地不断缩小,但并不能阻止已经损伤的区域,这种坏死区(红染区)的进行性扩大的现象可能是由于半暗带区的扩散性抑制或细胞凋亡造成的[7]。研究表明,坏死区和半暗带大脑皮层血流量随时间变化而不断改变,而利用大脑皮层(脑微循环(动物),旁流暗视野,侧流暗视野)血流量的检测可动态定位坏死区和半暗带区的位置及大小。c—f0s作为立早反应基因(1EGs)其表达并无特异性,在各种内外源性因素如外伤、缺血、癫痫等所造成的颅脑损伤均能诱导其表达,而正常情况下神经细胞无或极少表达。其机制可能为胞外刺激导致兴奋性谷氨酸(EAA)大量释放,NMDA受体激活,促使磷酸肌醇
)系统降解,三磷酸肌醇(PI3)含量增加,使内质网释放钙离子,并激活受体活化钙通道,钙离子大量内流,促进蛋白磷酸化,使IEGs大量迅速表达。现研究较多的是c—f0s和e-jun家族,两者通过形成异构二聚体复合物,与DNA链上的AP一1位点结合,参与细胞凋亡的调节过程。有研究表明脑缺血
(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)刺激c—f0s的表达能上调存活基因而产生神经保护作用[圳。也有实验表明局灶性脑缺血能诱导大脑皮质中c-f0s的大量表达,且于脑损害成正相关
,使用血管(脑微循环(动物),微血管(血液)影像观察仪(动物),旁流暗视野,侧流暗视野,可视化微循环监测技术)紧张素受体拮抗剂能降低c—f0s的表达,改善脑的缺血损伤I
。因而c—f0s在缺血中是起保护还是损伤作用一直存有争议,其真正意义有待进一步研究。此实验研究发现,c—f0s阳性细胞在光照后30min即有表达,但仅局限于半暗带区。3
h后阳性细胞除在半暗带区表达,同侧大脑皮层亦有表达,6
h上述位置阳性反应表达至高峰,且对侧皮层亦有表达。c—f0s的这种远隔部位的表达生理意义尚不清楚,可能与来源于缺血皮层的c—los抑制因子丢失有关,而这种因子可能通过多突触神经元通路传递[10】。本研究提示局灶性脑梗死(脑微循环(动物),旁流暗视野,侧流暗视野)是c-f0s表达的诱因之一,而且其表达具有明显的时间和空间的变化规律,这种变化与梗死的坏死区和半暗带的皮层血流量与面积关系密切,为探明局灶性脑梗死(脑微循环(动物),旁流暗视野,侧流暗视野)的发病过程及其防治提供了实验依据。
参考文献
1 王军.大鼠脑缺血模型研究进展EJ].中医研究.2002.15(5):6o~ 62
2 Cho S.Park EM,Kim Y,eta1.Early c—fosinduction after cerebralis—chemia:apossible
neumpmtective role[J]_J Cereb Blood Flow
Metab.2001,21(5):550-556
3 Dai WJ,Funk A,Herdegen T1 et a1.Blockad of central angiotensinAT_1
receptors improves neurological outconle and reduceses
expressionof AT_l transcription factors after focal brain
ischemia inrats【J J.Stroke.1999,30(1 1):2391~2398
4 Waston DB.Dietrich WD.Busto R Duction ofreproducible brain
infarctionsbyphotochemiealyinitiatedthrombosis【JlAnn NeuroL
1985,17:497-504
5
赵秀梅,刘育英,郑世荣,等.胰激肽原酶对大鼠微血管内血栓形成预防作用的研究[J].中国微循环.2002。6(6):332~334
6
韩东,廖福龙,李文,等.冷光源光化学诱导局灶性脑梗死及血管损伤半暗带大鼠模型[J]_中国微循环.2001,5(1):71—75
7 Witte OW,Stol G.Delayed and remote efects of focal cortical
infarction:seeondary damage and reactive plasticity[M
J.In:Freund}lJ.Sabel BA,Wire OW,eds.Brain Plasticity,Volume
73:Advan ces inNeurology.Philadelphia-PA:Lippieott—Raven.1997,207-227
8 Iliams AJ,Ling G,Berti R,et a1.Treatment with the snail
peptideCGX-lO07 reduces DNA damage an d alters gene expression
ofc-fos and bcl一2 following focal ischemic brain injury in
rats[J].Exp Brain Res.2003,153:16-26
9 Rau SW,Dubal DB,BottnerM,et 81.Estradid diferentially re 【l8c—fos
afterfocalcerebral ischemia[J].Journal of
neuroseience:theoficial journal of the Society for
Neuroseience.2003,23(33):l0487一l0494
10 Cui I. u PK.Neuronal NOS Inhibitor That Red uces Oxidative
DNALesions an d eumnal Sensitivity Increases the Expression of
Intactc-fos Transcripts after Brain Injury [J].Journal of
BiomedicalScience.2001,8:336—341
(收稿:2004—04—26 修回:2004—07—19) |