|
摘要 目的:观察大鼠头颅(大鼠头颅微血管,大鼠微血管)瞬间旋转引起脑神经轴索损伤的形态学改变并探讨其机理。方法:SD大鼠21只(对照组3只,损伤组18只)。采用自制头颅旋转致伤装置,将损伤组大鼠头颅(大鼠头颅微血管,大鼠微血管)于3ms内在冠状面绕脑中心右向旋转90°造成剪力伤,于伤后6、12、24、72、144小时分批处死动物制脑切片,行镀银及HE染色,光镜下观察神经轴索变化。结果:伤后即刻大鼠均意识丧失。3只15分钟内死亡,肉眼亦见蛛网膜下腔广泛出血。其余存活大鼠在伤后6至144小时,肉眼见蛛网膜下腔广泛出血,光镜下见脑干、胼胝体、大脑脚等部的神经轴索有程度不同的肿胀、断裂、轴缩球形成等征象,以脑干纵行纤维受损最重并伴纤维束间点状出血。延髓和中脑的上述变化分别在伤后6及24小时最重。结论:本研究成功地建立了大鼠头颅(大鼠头颅微血管,大鼠微血管)瞬间旋转脑弥漫轴索损伤模型,表明剪力可引起轴索损伤,脑微血管变化是加重轴索损伤的重要因素。
脑弥漫轴索损伤(diffuse axonal injury,
DAI)在重型颅脑(大鼠头颅微血管,大鼠微血管)损伤中占28%~42%,死亡率高达42%~62%(1,2,3),临床治疗十分棘手。本世纪80年代以后,国外采用颅瞬间旋转装置,复制出狒狒、幼猪DAI动物模型;但发现该二种动物模型中脑轴索损伤的分布形式有明显不同。本研究采用自制的头颅瞬间旋转装置,观察大鼠头颅(大鼠头颅微血管,大鼠微血管)在冠状面绕脑中心瞬间旋转90°后,脑神经轴索的形态学变化,探讨建立大鼠颅(大鼠头颅微血管,大鼠微血管)瞬间旋转脑DAI模型的可行性,旨在深入研究DAI致伤机理,并为指导临床诊治提供参考。
材料和方法
一、头颅(大鼠头颅微血管,大鼠微血管)旋转致伤装置制作
主要结构如下(图1):
1.固定部分:包括门齿孔、一对横向杆,双侧耳棒。
2.驱动弹簧:由直径4毫米钢丝制成,圈数为6,内径32mm,经烘烤定型后,预先顺时针扭转270°,固定于旋转装置内(其连带之横向杆此时呈上下排列)。
3.回位旋扭:用活动扳子将其顺时针方向拧动90°,可使横向杆由上下排列变为水平排列(此时,将麻醉后大鼠头颅(大鼠头颅微血管,大鼠微血管)经耳棒及门齿孔固定于横向杆上,躯干与实验台成20°角俯卧其上)。
4.扳机:向下按动,弹簧可获释放,固定部分遂带动鼠颅以横向杆连线中心为轴心逆时针转动90°,即相当于大鼠头颅(大鼠头颅微血管,大鼠微血管)于冠状面绕脑中心右向旋转90°。顺时针方向拧动回位旋钮,卸下动物,以备下次使用。
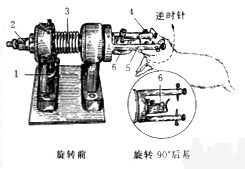
1.扳机 2.回位旋钮 3.驱动弹簧 4.耳棒 5.横向杆 6.门齿孔
二、动物分组与损伤实施
健康雄性SD大鼠21只,体重250~300g。随机分为损伤组18只,对照组3只。各组大鼠用乙醚麻醉后,按前述方法将其头颅(大鼠头颅微血管,大鼠微血管)固定于旋转装置上,待大鼠麻醉苏醒开始挣扎后,按动扳机。经第四军医大学生物力学教研室测算,整个90°旋转过程用时<3ms,角速度>767rad/s,角加速度>1.87×105rad/s2。正常对照大鼠(大鼠头颅微血管,大鼠微血管)一旦挣扎,即从装置上卸下。观察各组大鼠行为表现。对意识丧失者,记录旋转后至出现复正体位动作的时间,作为昏迷时程指标。实验中损伤大鼠有3只于旋转后15分钟内死亡,其余15只于伤后6、12、24、72、144小时分批处死(每批3只),行组织学处理。对照组3只从旋转装置上卸下后6小时处死,行组织学处理。
三、组织学处理
大鼠在预定时间行腹腔注射1%戊巴比妥钠麻醉(40mg/kg),开胸,主动脉插管。灌注生理盐水至冲净循环系统血液,再灌注10%福尔马林-磷酸盐缓冲液400ml固定组织(以上于20分钟内完成,灌注压12.0~13.3kPa),立即取全脑,肉眼观察脑部变化。将脑置于10%福尔马林-磷酸盐缓冲液中再固定1周。对照组3只及损伤组每批3只处死动物中,各取2只沿其脑矢状中线切开;另1只在延髓、桥脑、中脑(大鼠头颅微血管,大鼠微血管)及胼胝体中部平面冠状切开。脑组织行常规脱水、石蜡包埋。矢状块脑由中线向外侧切片,冠状块脑由后向前切片,片厚8μm,隔25片取3片。裱片,烘干,脱蜡至水。2片行Glees-Marsland镀银染色,1片行HE染色。用Olympus光镜观察。伤后早期死亡的3只大鼠,于死后即刻取脑,肉眼观察脑部变化。
四、数据分析
有关数据采用第四军医大学统计学教研室研制的SPLM统计软件进行处理。
结 果
一、伤后行为变化
损伤组大鼠伤后均有原发意识丧失,伴呼吸浅快或深慢。3只于15分钟内死亡。存活者昏迷时间2~25分钟,平均13.5分钟;苏醒后72小时内反应迟钝。对照组大鼠从装置上卸下后,活动如常。
二、伤后脑组织病理变化
(一)大体观察
伤后15分钟内死亡的大鼠在小脑及大脑枕顶部广泛蛛网膜下腔出血,右侧半球(脑向颅底运动)重于左侧(脑向颅(大鼠头颅微血管,大鼠微血管)顶运动),大脑底面有小灶状出血点,无明显脑挫裂区。存活鼠于伤后6~144小时观察见上述出血随时间逐渐吸收。
(二)显微镜观察
1.镀银染色:矢状切片 损伤后6小时,在大鼠(大鼠头颅微血管,大鼠微血管)延髓腹侧纵行神经轴索之间,空隙增宽,有大量嗜银较强的棕黑色粗大轴索。其走行纡曲,局部扩大如“串珠”,为轴索肿胀(axonal
swelling)征;个别者末端膨出如梭,大小不一,约5~15μ,此即轴缩球(axonal retraction
ball)(图2)。中脑顶盖区纵行神经轴索束间亦见粗大轴索,局部肿胀。在其走行路径上有多处中断,个别断端形成轴缩球(图3)。对照组大鼠(大鼠头颅微血管,大鼠微血管)延髓、中脑神经轴索排列密集,尽管其直径不尽相同,但差距不大,且表面相对平滑,无轴索肿胀、断裂及轴缩球(图4、5)。伤后12小时,延髓腹侧及中脑顶盖区上述征象继续存在,于胼胝体体部始见少数神经轴索局部增粗。伤后24小时,延髓神经轴索局部肿胀和轴缩球有所减少,但中脑顶盖区轴缩球数量明显增多,胼胝体区亦出现少量轴缩球(图6)。伤后3~6天,延髓、中脑、胼胝体区上述轴索损伤性改变明显减轻,伴发胶质细胞弥漫增生。脑损伤后桥脑腹侧、大脑脚、上下小脑脚、内囊、视束及小脑白质等部散在可见神经轴索轻微肿胀,大脑皮层白质下神经轴索未示明显变化。
冠状切片:各时点观察,仅伤后24小时见中脑顶盖区、伤后3天小脑白质区有少量轴缩球出现。
2.HE染色
神经轴索呈嗜伊红色,轴索肿胀和轴缩球不易同神经元胞体之断面区别。因此,该染色难以用于观察轴索损伤性变化。伤后6~24小时,在延髓及中脑可见多处小出血点。伤后6天,延脑显示广泛小胶质细胞增生,可见小胶质细胞巢落,其中夹杂着双核及分叶核胶质细胞。
一、DAI概念及动物模型
1982年Adams等(5)对一组主要由车祸所致的重型颅脑损伤进行研究。尸检肉眼观无明显的占位病变,光镜下见胼胝体、脑干上端、大脑(大鼠头颅微血管,大鼠微血管)白质等部广泛神经轴索肿胀、断裂并出现轴缩球;患者多于伤后即刻长时昏迷,其伤情严重程度与轴索变化极为相关。为此,Adams提出DAI概念,来描述这类由外力作用引起的,以脑深部神经轴索变化为病理特征的脑损伤。目前,DAI已被视为一种独立的脑损伤类型;但其发病机理,尚不完全清楚。
建立DAI动物模型,对于深入研究DAI有重要意义。本世纪80年代初,Gennarelli等(6)将狒狒头颅(大鼠头颅微血管,大鼠微血管)在冠状面于11~22ms旋转60°,在临床及病理上证实复制出酷似人脑DAI的非人灵长类动物模型,并强调了“弥漫施力、瞬间作用、旋转效应”等力学因素在DAI发病中的决定意义。Ross等(7)将幼猪头颅在6ms内于冠状面旋转60°~105°,也证实获得DAI模型。Margulies等(8)根据物理模型研究结果,提出外力大小须使狒狒头颅旋转时的角速度、角加速度分别不低于260rad/s、1×105rad/s2才能促发DAI。传统观点认为动物脑质量越大,颅(大鼠头颅微血管,大鼠微血管)瞬间旋转越易引发DAI,故目前罕有小动物(如大鼠)颅(大鼠头颅微血管,大鼠微血管)旋转DAI模型的报道。
本研究中,大鼠头颅(大鼠头颅微血管,大鼠微血管)于3ms内在冠状面旋转90°,脑部角速度>767rad/s,角加速度>1.87×105rad/s2,二者均大于Margulies报告的DAI力学参数阈值。伤后大鼠全部出现昏迷,伴呼吸节律紊乱,个别者于15分钟内死亡,死亡率17%,可能因中枢性呼吸功能衰竭所致。存活者原发昏迷持续时间可长达25分钟。伤后6小时至6天镀银染色光镜下见延髓、中脑、胼胝体、小脑白质、桥脑、大脑脚、小下小脑脚、内囊等广泛区域有分布不匀、程度不一的神经轴索局部肿胀和(或)轴缩球,伤后6天在脑干存在胶质细胞肥大及增生性改变。可见,本大鼠模型具有DAI一般特征。
二、DAI发生的时、空特征
在人类DAI及非人灵长类动物颅旋转DAI模型中,轴索肿胀及轴缩球等征象多见于胼胝体、内囊、脑干上端及大脑白质(5,6,9)。Ross等(7)的幼猪DAI模型中,轴索损伤主要居于大脑白质浅层。Povlishock(10)指出,小动物轴索损伤好发于脑干。本研究中,大鼠颅(大鼠头颅微血管,大鼠微血管)旋转DAI在病理上也集中在脑干内,在临床上除表现为意识障碍外,尚伴有呼吸节律紊乱等其它脑干机。
附表 伤后不同时间大鼠各脑区轴缩球密度(个/160×160μ2)(±s)

能异常。可见,病理与临床表现是一致的。轴索损伤的分布,与物种间颅脑(大鼠头颅微血管,大鼠微血管)解剖结构不同有关。灵长类动物有坚硬的大脑镰,因而头颅加-减速运动时,镰下的胼胝体极易受累。
文献表明,人脑轴缩球出现于伤后12小时以上,动物轴缩球出现较早,但幼猪DAI模型中此期不短于6小时(7)。本研究中大鼠伤后6小时在延髓腹侧及中脑顶盖区即见大量轴索肿胀和轴缩球;延髓轴缩球密度以伤后6小时最高,随时间逐减,中脑在伤后24小时轴缩球密度达峰值;胼胝体仅在伤后24~72小时出现少量轴缩球。各时点综合分析,见轴缩球密度在延髓、中脑、胼胝体呈递减之势。
三、DAI致伤机理
前述的轴索损伤时、空特征,证实DAI是由剪力致伤之后引起的、呈规律性演变的一个过程,因此应属于继发性损伤,轴索的改变并非在伤后立即出现。头颅(大鼠头颅微血管,大鼠微血管)瞬间旋转使脑在惯性驱导下作非线性加-减速运动,其间产生一种与旋转轴相垂直的剪切力。这一剪力作用于桥静脉,引起蛛网膜下腔出血;作用于脑实质微血管,可致脑组织内点状出血;作用于神经纤维,则致轴索损伤。Maxwell等(11)扫描电镜研究证实,狒狒头颅(大鼠头颅微血管,大鼠微血管)瞬间旋转后血脑屏障存在明显异常。本研究中损伤鼠也表现有蛛网膜下腔出血及脑实质内点状出血。这表明,颅内血管改变是伴随轴索损伤的一个重要因素;提示,及早改善脑微循环(大鼠头颅微血管,大鼠微血管),在DAI的临床救治中似应具有一定裨益。
参考文献
1 Adams JH, Gennarelli TA, Maxwell Wl. Diffuse axonal injury in
nonmissile head injury. J Neurol Neurosurg Psychiatry,
1991,54:481-483.
2 Bennett M. Clinicopathologic observations in 100 consecutive
pattens with fatal head injury admitted to a neurosurgical unit.
Ir Med J, 1995,88:59-62.
3 赵孟尧,过宗南,刘建民,等.脑弥漫轴索损伤.中华神经外科杂志,1991;7:93-95.等文章
作者单位:710032 西安,第四军医大学西京医院神经外科 |