|
摘要 目的: 观察大蒜新素(allitridi,All)对大鼠软脑膜微循环(大鼠头颅微循环,大鼠微循环)的影响。方法:用颅骨开窗技术,运用微循环图像处理(MCIP)系统,实时记录测量大鼠软脑膜血管管径。结果 表面给药All1
μmol.L-1~100 μmol.L-1可使软脑膜微动脉(pial arteriole,PA)
扩张5%~28%。在四动脉结扎造成大鼠全脑缺血模型上,结扎两侧颈总动脉20 min后,表面给予All 1
μmol.L-1~100 μmol.L-1可使PA扩张12%~54% 。另外,缺血前15 min给予All
1.5,3.0,6.0 mg.kg-1
iv可改善四动脉结扎所致全脑缺血大鼠的软脑膜微循环(大鼠头颅微循环,大鼠微循环),扩张软脑膜血管管径。结论 大蒜新素可改善因缺血造成的脑微循环障碍,减少因缺血引起的脑组织损伤作用。
大蒜新素为大蒜中主要有效成分之一,具有广泛的药理作用,其抗脑梗塞作用也有临床报道。All化学性质稳定,可以人工合成。动物实验表明All对脑缺血(再灌注)小鼠和大鼠具有一定的保护作用,为探讨其作用机制,用颅骨开窗技术,运用微循环图像处理系统(Microcirculation
image processing system,MCIP
system),实时记录了All对大鼠软脑膜微循环(大鼠头颅微循环,大鼠微循环)的影响。在微循环的研究中,软脑膜微循环(大鼠头颅微循环,大鼠微循环)实验方法的优点在于可连续地直接观察软脑膜微循环的动态变化,而软脑膜微循环是脑血管床的一部分,管径在100μm以下的软脑膜血管在各种病理情况下可发生明显的变化,其直径以及管内红细胞流速流态的变化,可基本反映脑微循环(大鼠头颅微循环,大鼠微循环)的变化。有报道证实,颅骨开窗观察软脑膜血管对脑的生理功能影响不大。因此,选择了直径在20~100μm的微血管为观察对象
1材料和方法
1.1 动物 Sprague-Dawley大鼠,体重300~350 g,♀♂兼用,由江苏省实验动物中心提供。
1.2 药品和仪器 大蒜新素(allitridi,All)纯度>90%,由江苏省连云港天睛制药厂提供,用PEG400溶解至所需浓度;尼莫地平(nimodipine,Nim)溶液为德国Bayer公司产品;去甲肾上腺素重酒石酸盐(noradrenaline
bitartrate, NA);氯化乙酰胆碱(acetylcholine chloride,Ach)上海第二制药厂;其它试剂与药品为市售分析纯。XY-3微循环(大鼠头颅微循环,大鼠微循环)显微镜由江南光学仪器厂制造;微循环图像处理系统由中国医学科学院微循环研究所提供。
1.3 颅骨骨窗的制作 动物用200 g·L-1乌拉坦1.0 g·kg-1 ip麻醉,用红外灯使肛温维持在37~38℃,颅顶正中皮肤“T”形切开,以矢状缝外3
mm、冠状缝下3 mm为中心,用手术刀片刮去颅骨,逐层分离硬脑膜、蛛网膜,暴露软脑膜,形成一椭圆形窗口。
1.4 大鼠(大鼠头颅微循环,大鼠微循环)全脑缺血模型制备 选取体重300~350 g的Sprague-Dawley大鼠,按文献方法[1]稍作改动。大鼠200
g·L-1乌拉坦1.0 mg·kg-1 ip麻醉,分离双侧颈总动脉,从颈背部电凝双侧椎动脉24
h后,以动脉夹夹闭双侧颈总动脉20 min,再打开动脉夹再灌注120 min,选择1~4级微动脉(A 1:100~60 μm、A
2:60~40 μm、A 3:40~20μm、A 4:20 μm以下)动态观察给药前、给药后20
min以及再灌注后30、60、90、120 min软脑膜微动脉(大鼠头颅微循环,大鼠微循环)(PA)管径的变化。
1.5 给药方法
1.5.1 软脑膜表面给药方法 表面给药系将药物用人工脑脊液(artificial cerebrospinal
fluid,ACSF)稀释而成。ACSF配[2] :以去离子三蒸水配制,终浓度(mmol·L-1):NaCl124.0,KCl
3.3,KH2PO4 1.2,NaHCO3 26.0,CaCl22.5,MgSO4 2.4,gluocose
10.0,以混合气体(0.95 O2+0.05 cO2)饱和,pH 7.3~7.4,37℃保温。每次0.1
ml表面给药,观察给药前和给药后5 min内血管管径的变化。每种药物反应观察后,用ASCF冲洗,待血管恢复给药前状态时,再给予第二种药物。对照组给予不含药物的ACSF,给药次序随机。四动脉结扎所致脑缺血动物(大鼠微循环)中药物于结扎双侧颈总动脉后20
min表面滴加含或不含药物的ACSF。
1.5.2 静脉给药方法 电凝双侧颈总动脉24 h后,结扎双侧颈总动脉前15 min静脉给予药物。
1.6 数据分析 实验数据以X±s表示,采用t检验进行统计学分析。
2 结果
2.1 表面给药对软脑膜微循环(大鼠头颅微循环,大鼠微循环)的影响
2.1.1 对正常大鼠软脑膜(大鼠头颅微循环,大鼠微循环)动脉管径的影响 给药前PA管径为(30.5±3.1)μm,滴加不含药的ACSF时,管径无明显变化。去甲肾上腺素(noradrenaline,NA)100μmol·L-1可使其收缩23%,氯化乙酰胆碱(acetylcholine
chloride,Ach)100 μmol·L-1可使其扩张29%,Nim 10 μmol·L-1可使其扩张71%,All1
μmol·L-1~100 μmol·L-1可使PA扩张5%~28%。
2.1.2 对四动脉结扎致大鼠(大鼠微循环)全脑缺血时软脑膜动脉管径的影响 四动脉结扎20
min后,软脑膜微血管(大鼠微循环)已有所收缩。表面给予NA 10 μmol·L-1可使其收缩32%,Nim可使舒张24%,All1
μmol·L-1~100 μmol·L-1可使PA扩张12%~54%。
2.2 静脉给药对四动脉结扎所致全脑缺血大鼠软脑膜微循环(大鼠头颅微循环,大鼠微循环)
影响 观察了A1~A 4级微血管,缺血后20 min,A 1~A
3级微血管分别较缺血前缩小了4.98%±1.99%、13.76%±1.55%、14.71%±6.10 %,A
4级微血管有的出现闭合。再灌注后管径逐渐扩张,约50 min血管又有回缩,到60 min已比原来管径有所下降,而缺血前给以
all 1.5,3.0,6.0 mg·kg-1 iv组及Nim 0.02 mg·kg-1
iv组可减少缺血及再灌注期血管管径收缩,也减少A 4血管的闭合,与缺血组比,All1.5,3.0,6.0 mg·kg-1
iv可使A 1~A 3级都有不同程度改善(见表1,表2,表3)。
软脑膜微血管(大鼠头颅微循环,大鼠微循环)流速在正常情况下除极少数A
4级微动脉呈线粒流,其它各级血管均呈线流,脑血流阻断后,镜下首先可见微静脉血流减慢,直至停止。缺血再灌注后初期,微血管由大至小逐级开放恢复成线流,缺血组在再灌50
min后有的出现血管收缩,80 min后各级微血管流速减慢,尤以微静脉明显,部分微静脉血栓开始形成,血流中断,而All和Nim在扩张血管同时流速仍为线流。非缺血对照组管径流速、流态变化不显著.
3 讨论
四动脉结扎所致全脑缺血后,微血管(大鼠微循环)血流缓慢,红细胞聚集,微动脉痉挛,出现脑缺血早期的微循环(大鼠头颅微循环,大鼠微循环)障碍现象。维持足够的灌注是能量代谢必要的条件。研究发现脑缺血再灌注后,大脑首先有一过性的血管扩张,约60
min后,血流即又显著地进行性减少。现认为这种延迟性低灌与缺血的神经功能恢复密切相关。缺血再灌注性脑损伤主要发生在延迟性低灌期[3]。本研究结果表明,再灌60
min左右,各级微动脉收缩,至90
min时,在微(大鼠头颅微循环,大鼠微循环)血管继续收缩的基础上流速也下降,并又重新出现静脉微小血栓。给予大蒜新素和尼莫地平治疗皆可改善缺血所致的微循环(大鼠头颅微循环,大鼠微循环)障碍。当脑组织缺血缺氧时,能量耗竭,膜离子泵活力下降,加之兴奋性氨基酸过度释放等一系列病理改变,细胞内钙离子浓度大大增加,致使血管痉挛。大量研究表明[4,5],Ca2+通道阻滞剂可阻断Ca2+内流入细胞,从而降低脑血管平滑肌内Ca2+含量。体外实验表明[6],All体外呈剂量依赖性地阻断Ca2+通道,抑制血管平滑肌收缩。另有研究报道[7],All可以提高脑Na+,K+-ATPase和Ca2+,Mg2+-ATPase活性,从而减少细胞内Ca2+。本实验其它部分证实,All可提高Na+,K+-ATPase和Ca2+,Mg2+-ATPase活力以及降低神经细胞内游离Ca2+含量,从而减少内Ca2+超负荷所致的一系列生化连锁反应,防止或解除脑血管痉挛,有利于脑皮层(大鼠微循环)供血,防止或减轻脑细胞代谢异常。另外大量研究表明[8~11],All无论在体内和/或体外都有很强的抗血小板聚集活性,可对抗急性脑梗塞患者外周血的细胞滤过指数增高[12],改善血液流变性,减轻缺血组织损伤。可以对抗自由基对细胞膜的攻击和损伤[13],而目前认为组织缺血后,特别是象脑组织这样氧利用率很高的组织,缺血再灌注时,尤其易受活性氧和氧自由基损伤。All可通过多种途径改善脑微循环(大鼠头颅微循环,大鼠微循环),同时其脂溶性大,易透过血脑屏障,故对脑血管平滑肌选择性较强。
Tab 1 Effect of allitridi on the
pial arteriole(60~100 μm) diameters and diameter changes(%)in
ischemia-reperfusion rats(X±s,n=5)
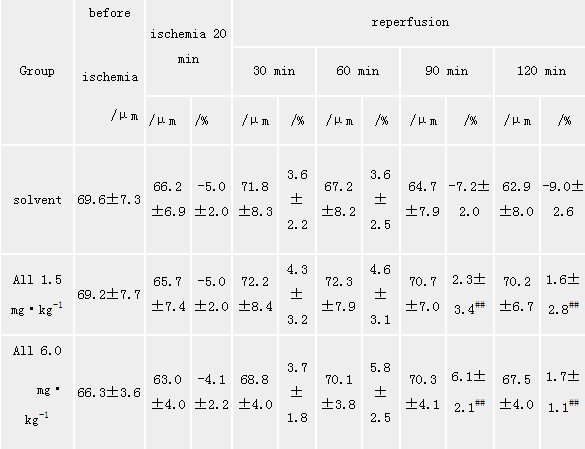
solvent:PEG 400;##P<0.01 vs pEG 400 Tab 2 Effect of allitridi on the pial
arteriole(40~60 μm) diameters and diameter changes(%)in
ischemia-reperfusion rats(X±s,n=5)
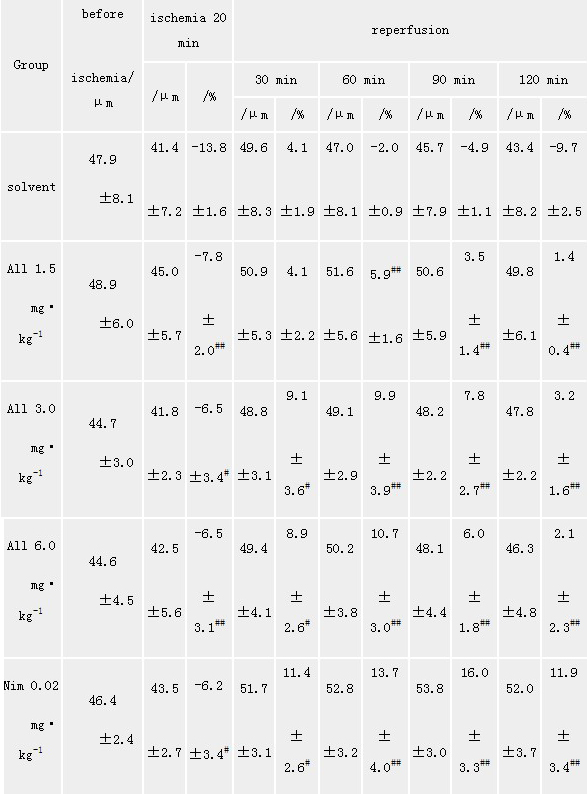
solvent: PEG 400;#P<0.05,##P<0.01 vs PEG 400
Tab 3 Effect of allitridi on the pial
arteriole(20~40 μm) diameters and diameter changes(%)in
four-vessel occlusion ischemia-reperfusion rats
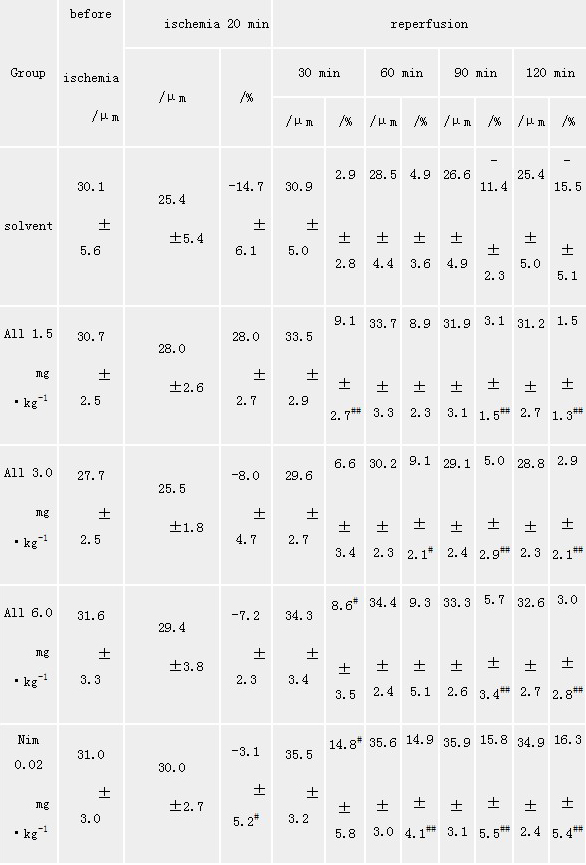
solvent:PEG
400;#P<0.05, ##P<0.01 vs PEG 400
研究结果表明:对于四动脉结扎所致全脑缺血所致脑缺血大鼠软脑膜微循环(大鼠头颅微循环,大鼠微循环)障碍,缺血前给予All能扩张微动脉,且对A2、A
3扩张程度大于A
1,表明对末梢微动脉作用更强,同时还可改变微循环的流态,阻止微小血栓的再形成,较好地改善脑缺血后微循环异常,使缺血和再灌注期脑血流增加,保持一段时期的高灌注状态及延迟低灌注时相产生,减少再灌损伤,有利于脑缺血后神经功能的恢复。
作者简介:马晓红,女,29岁,博士,现协和医科大学药物研究所博士后马晓红(南京医科大学药理学教研室,南京 210029)
马晓红(现在中国医学科学院.中国协和医科大学药物研究所,北京 100050)
许逸(南京医科大学药理学教研室,南京 210029)
潘鑫鑫(南京医科大学药理学教研室,南京 210029)
刘天培(南京医科大学药理学教研室,南京 210029)
参考文献
1.Pulsinelli WA, Bucham AM. the four-vessel occlusion rat
model: method for complete occlusion of vertebral arteries and
control of collateral circulation. Stroke,1988;19(7):913~4
2.刘振伟,王福庄,丁爱石 et al.钙离子在海马脑片缺氧损伤中的作用.中国应用生理学杂志,1994;10(1):34~7
3.White BC. Effect of flunarizine on canine cerebral cortical
blood flow and vascular resistance post cardiac arrest. Ann
Emerg Med,1982;11:119~26
4.White BC. Calcium blockers in cerebral resuscitation.J
Trauma,1983;23:788~94
5.Meyer FB. Focal cerebral ischemia: pathophysiologic
mechanisms and retionale for future avenues of treatment. Mayo
Clin Proc,1987;62:35~55 等文章 |